Sistema UDI de la FDA
La FDA (Food and Drug Administration o Administración de Alimentos y Medicamentos) de Estados Unidos, está implantando el sistema UDI para garantizar la correcta identificación de los dispositivos comercializados en Estados Unidos, desde su fabricación hasta la distribución y el uso por parte del paciente.
Los dispositivos médicos abarcan una amplia gama de productos: implantes, escáneres de TC, instrumentos quirúrgicos, lentes de contacto, sillas de ruedas o pruebas de glucosa en sangre, entre muchos otros. A diferencia de los medicamentos, muchos de estos dispositivos no disponen aún de un identificador único que los distinga claramente unos de otros. El sistema UDI viene a resolver esta situación, aportando un método coherente y estandarizado para identificar los dispositivos médicos durante toda su cadena de distribución y uso por parte de profesionales sanitarios y pacientes.
La mayoría de dispositivos deberán incluir un UDI en su etiqueta y embalaje y, en determinados casos, directamente en el propio producto. Asimismo, los fabricantes están obligados a enviar a la GUDID cierta información sobre estos dispositivos (se pronuncia “Good ID”).
Nota: la base de datos no recoge ni contiene información sobre pacientes ni sobre las personas que utilizan los dispositivos.
Categorización
La GMDN (Global Medical Device Nomenclature) es un sistema internacional creado para disponer de un lenguaje común en la identificación de dispositivos médicos. Cada entrada consta de un código numérico, un nombre de término y una definición, lo que permite describir el dispositivo de manera precisa y homogénea en cualquier jurisdicción. Su finalidad es facilitar la interoperabilidad entre autoridades regulatorias de distintos países, la trazabilidad y la vigilancia post-comercialización a nivel global. Por ejemplo, un bisturí quirúrgico tendría un código GMDN específico, acompañado de una definición estandarizada, que será reconocido por cualquier agencia que utilice este nomenclador.
La GMDN se usa también por la UE en contexto regulatorio, aunque fue reemplazada por la EMDN como nomenclatura oficial para EUDAMED.
En paralelo, la FDA utiliza su propio sistema de categorización: el FDA Product Code. Se trata de un código alfanumérico de tres caracteres que no solo identifica el tipo de dispositivo, sino que además lo vincula directamente con la normativa estadounidense aplicable (el número de parte del CFR correspondiente), la clase de riesgo asignada por la FDA y el tipo de autorización regulatoria que requiere (510(k), PMA, etc.). Así, un catéter de dilatación esofágica, por ejemplo, se encuentra bajo el código DXH, Clase II, con obligación de presentar un 510(k).
La razón por la que coexisten ambos sistemas es que cumplen funciones distintas: el GMDN proporciona una nomenclatura universal, pensada para compartir datos de dispositivos entre distintas autoridades sanitarias y para armonizar la comunicación global. En cambio, el FDA Product Code responde a una lógica regulatoria interna de Estados Unidos, que necesita codificar los dispositivos de acuerdo con su marco legal propio. En consecuencia, en muchos casos un dispositivo tendrá un código GMDN que lo identifica a nivel internacional, y un Product Code que lo encuadra específicamente en el sistema regulatorio de la FDA.
Cómo funciona el UDI
Un UDI está compuesto por dos partes:
Identificador de Dispositivo (DI): un código numérico o alfanumérico único, específico para una versión o modelo de dispositivo.
Identificadores de Producción (PI): códigos numéricos o alfanuméricos que aportan información de producción y que pueden incluir:
Número de lote o partida.
Número de serie.
Fecha de caducidad.
Fecha de fabricación.
En el caso de productos de células o tejidos humanos (HCT/P) regulados como dispositivos: un código de identificación que permite al fabricante asociar el producto con el donante.
Los UDI se crean a partir de estándares internacionales de identificación única. Las organizaciones privadas denominadas Agencias Emisoras (“Issuing Agencies”) son acreditadas por la FDA para gestionar la emisión de UDI siguiendo estos estándares.
Un UDI en la etiqueta de un dispositivo aparece tanto en texto legible para humanos como en formato legible por máquina.
Ejemplo de UDI (GS1)
Formato de código de barras 1D (legible por máquina):
En el sistema GS1, los números entre paréntesis indican las diferentes partes del UDI:
(01) Device Identifier (DI):
12345678901234Production Identifiers (PI):
(17) Fecha de caducidad: 270203 (03 de Febrero de 2027 en formato YYMMDD)
(11) Fecha de fabricación: 200302 (02 de Marzo de 2020 en formato YYMMDD)
(10) Número de lote: Z
1234(21) Número de serie:
1234
Etiquetado de artículo
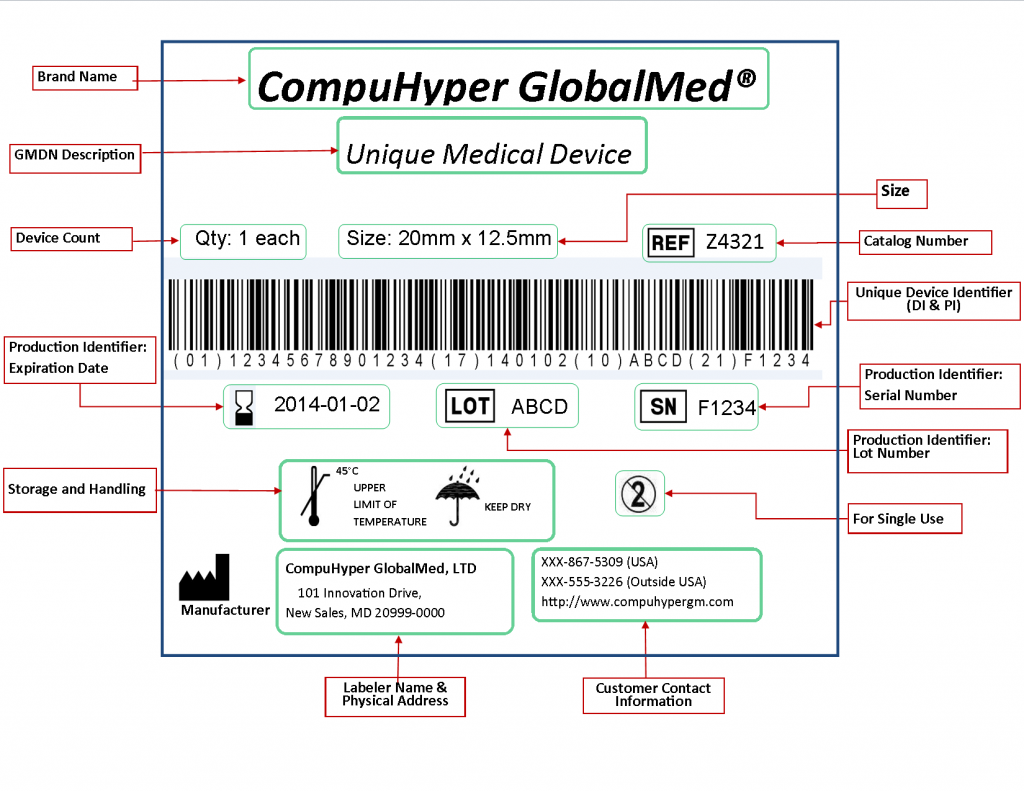
Esta imagen muestra un ejemplo de etiqueta de un dispositivo médico con todos los elementos que exige el sistema de Identificación Única de Dispositivo (UDI) regulado por la FDA.
En ella se destacan los siguientes puntos:
Grand Name: identifica comercialmente el producto y su clasificación técnica.
GMDN Description: Categorización GMDN
Device Count: cantidad que guarda la caja
Size: dimensión del artículo (no del embalaje)
Ref: número de catálogo o referencia interna del fabricante
UDI: aparece en código de barras y en texto legible; combina:
DI (Device Identifier): código que identifica el modelo o versión del dispositivo.
PI (Production Identifiers): información de producción, como fecha de caducidad, fecha de fabricación, número de lote o número de serie.
Storage and Handling: símbolos que indican, por ejemplo, la temperatura máxima o la necesidad de mantenerlo seco.
Labeler Name & Physical Address: nombre, dirección del fabricante.
Customer Contact Information: datos de contacto para clientes.
Uso previsto: indicación de si es de un solo uso.
La etiqueta integra en un solo formato la información esencial que permite identificar, rastrear y manejar de forma segura un dispositivo médico en todo su ciclo de vida, desde el fabricante hasta el paciente.

